近日,我校黃張建/吳建兵團隊在權威期刊Journal of the American Chemical Society上發表了題為“Warhead Strategy for Targeted Protein S-Nitrosation”的最新研究成果。我校2022級博士生張宸、博士后葉輝和2022級博士生紀多睿為論文的共同第一作者,我校黃張建研究員、吳建兵副研究員為通訊作者,中國藥科大學為論文的第一通訊單位。
關于蛋白翻譯后修飾的研究在藥物研發中扮演著重要角色。一氧化氮(Nitric Oxide, NO)是一種氣體自由基信號分子,由NO介導的蛋白巰基亞硝化(S-Nitrosation, SNO)是一種重要的翻譯后修飾,其由NO和半胱氨酸巰基反應生成SNO基團。蛋白亞硝化可影響蛋白的功能,蛋白-蛋白相互作用,以及蛋白的其他翻譯后修飾,介導多樣的生物學效應。特定蛋白關鍵位點亞硝化與疾病發生發展的關系研究是生物大分子動態修飾領域的前沿之一,但如何利用藥物化學方法對特定蛋白關鍵位點亞硝化實現精準干預,進而產生疾病治療活性,目前還是空白領域。其主要難點在于NO具有氣體自由擴散的性質,現有療法難以將其限制于特定蛋白發揮作用。
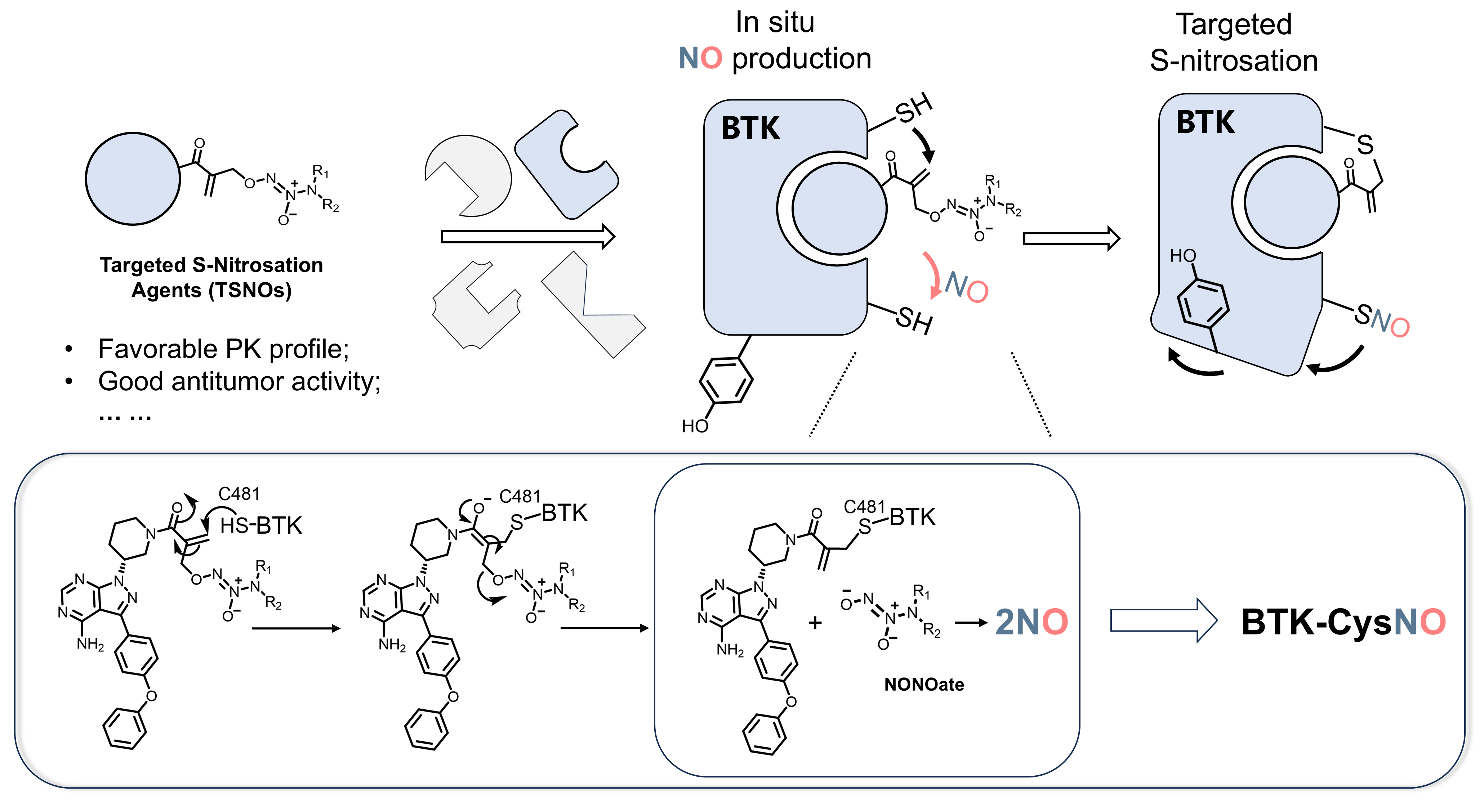
針對上述關鍵科學問題,團隊利用共價抑制劑策略,設計、合成了一系列NO釋放型彈頭,并將其分別搭載在靶向激酶BTK、FGFR4和HER2的小分子配體母核上,使得靶蛋白特定巰基與彈頭發生共價結合的同時能夠釋放NO,NO在極小范圍內分布并對靶蛋白自身產生選擇性亞硝化修飾。結果表明,選擇性亞硝化調控劑TSNO1-8具有較優的體外穩定性、良好的藥代性質、較優的激酶譜選擇性以及較優的體內外抗淋巴瘤活性。進一步的亞硝化組學研究表明,選擇性亞硝化調控劑TSNO1在體內、體外均能對BTK的Cys527產生選擇性亞硝化修飾,此位點的亞硝化修飾破壞了BTK激酶結構域構象,使得Tyr551被氫鍵包埋,進一步影響了BTK的激酶信號轉導。綜上所述,本研究不僅為選擇性亞硝化調控提供了新方法,也為選擇性翻譯后修飾藥物開發提供了新思路。
該研究工作獲得了國家自然科學基金、中國藥科大學“雙一流”建設經費、興藥領軍學者等經費的支持。
彈頭策略實現選擇性亞硝化示意圖
(供稿單位:多靶標天然藥物全國重點實驗室,撰稿人:單思明,審稿人:劉帆)