近日,我校基礎(chǔ)醫(yī)學(xué)與臨床藥學(xué)學(xué)院于燁教授團(tuán)隊(duì)研究團(tuán)隊(duì)在膜受體非經(jīng)典的偏好性信號調(diào)控方向取得研究進(jìn)展,部分研究成果近期已在Neuron, Nat Commun, eLife等期刊發(fā)表。
研究發(fā)現(xiàn),存在于細(xì)胞表面的膜受體作為主要的生理傳感器,涵蓋了視覺、嗅覺、溫度和壓力感知等眾多受體,具有多種對細(xì)胞和生物組織至關(guān)重要的生物功能。許多疾病均與膜蛋白功能異常有關(guān),使其成為了藥物開發(fā)領(lǐng)域的重要靶點(diǎn)。目前,超過50%的小分子藥物以人類膜蛋白為靶標(biāo),G蛋白偶聯(lián)受體 (GPCRs) 和離子通道兩類膜受體位列前二(圖1)。膜蛋白受體的偏好性/精細(xì)變構(gòu)提供了新的時(shí)間和空間信號,通過優(yōu)先穩(wěn)定受體的不同活性構(gòu)象狀態(tài)來誘發(fā)不同的細(xì)胞信號傳導(dǎo)。這種更為精細(xì)的調(diào)控或許能夠限制副作用的發(fā)生,使得更多“不可成藥”的膜蛋白成為治療靶標(biāo),并將其治療效果與副作用得以分離。
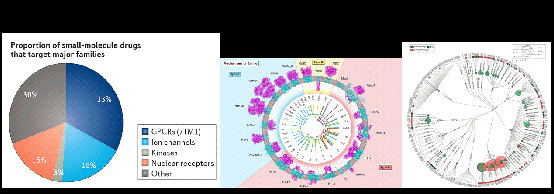
圖1.目前上市的小分子藥物中, 50%以上是以人類膜蛋白為靶標(biāo)的,其中G蛋白偶聯(lián)受體 (GPCRs) 和離子通道兩類膜受體位列前二(圖片來源:Hauser et al.,Nat Rev Drug Discov, 2017,Baron Chanda, et al. Cell,2017;Santos R et al., Nat Rev Drug Discov, 2017)。
辣椒素(香草素)受體TRPV1是一種非選擇性陽離子通道。最初,David Julius教授在探索辣椒素引起痛覺的機(jī)制時(shí)發(fā)現(xiàn)了TRPV1。隨后,Julius教授在研究TRPV1如何感知熱量時(shí)意識到,TRPV1還是一種熱敏受體——在感受痛覺的溫度下,受體被激活。目前,多種TRPV1拮抗劑候選藥物進(jìn)入了臨床試驗(yàn)階段。不過,TRPV1激動劑/拮抗劑的研發(fā)面臨一大挑戰(zhàn),即它們往往會引起人體核心體溫的劇烈變化,這極大限制了相關(guān)藥物的使用可能性。至今,為何TRPV1靶向藥物在鎮(zhèn)痛的同時(shí)會引起核心體溫的劇烈變化,其中的分子機(jī)制尚不清楚。基臨院于燁教授領(lǐng)銜的膜生物物理與化學(xué)生物學(xué)課題組成員在《Neuron》上在線發(fā)表的題為“TRPV1 analgesics disturb core body temperature via a biased allosteric mechanism involving conformations distinct from that for nociception”論文為我們解答了這一問題。該項(xiàng)研究工作首次提出TRPV1中在同一位點(diǎn)結(jié)合不同配體的細(xì)微差別編碼了痛覺和體溫調(diào)節(jié)的功能。這一發(fā)現(xiàn)挑戰(zhàn)了將受體視為簡單開與關(guān)的傳統(tǒng)觀點(diǎn),并突出了通道蛋白也存在連續(xù)、偏好性信號編碼的受體復(fù)雜性,為研發(fā)TRPV1靶向且不改變體溫的非阿片類鎮(zhèn)痛藥物研發(fā)提供了扎實(shí)的基礎(chǔ)(圖2)。中國藥科大學(xué)博士生黃毅哲、博士后孫萌陽、碩士生馬靜嫻、博士生邊宇婧為本文的主要貢獻(xiàn)者。全文鏈接如下:https://doi.org/10.1016/j.neuron.2024.02.016
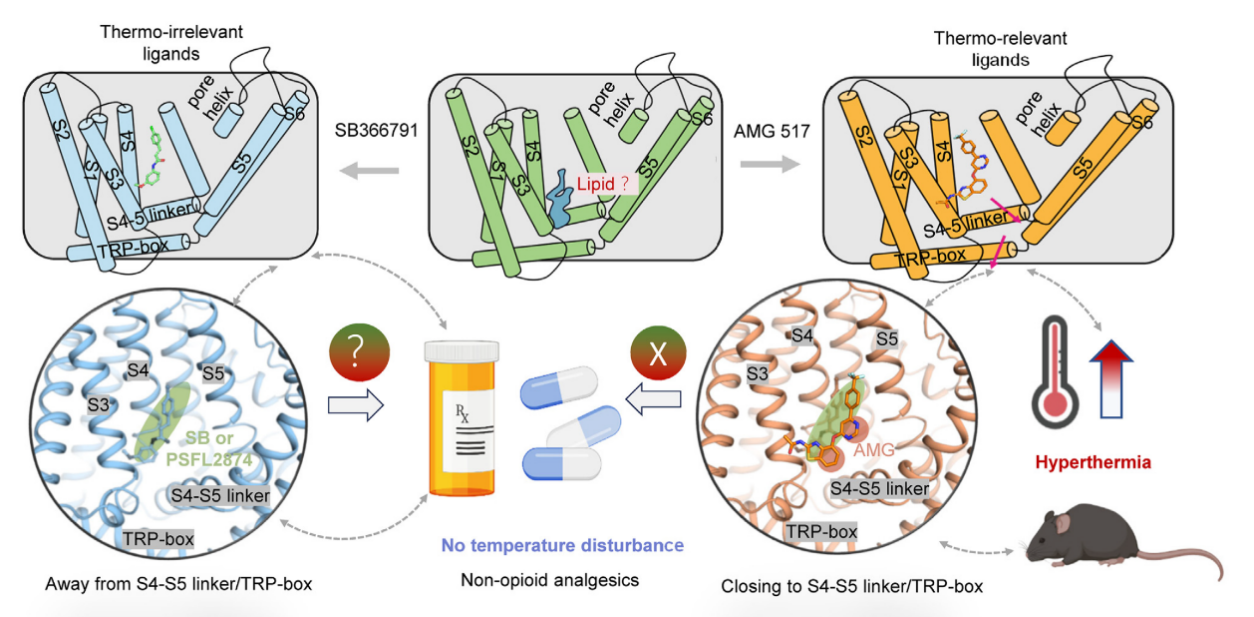
圖2. 離子通道的配體在同一位點(diǎn)的微小差異也可介導(dǎo)偏好性信號編碼(圖片來源:Huang YZ et al., Neuron, 2024. 6)
與TRPV1鎮(zhèn)痛策略相似,針對P2X3受體為靶標(biāo)的鎮(zhèn)咳藥物在止咳同時(shí)常伴隨有味覺失調(diào)等副作用的問題,該團(tuán)隊(duì)利用電壓鉗熒光法聯(lián)合全細(xì)胞膜片鉗等技術(shù),發(fā)現(xiàn)了P2X3受體新的變構(gòu)調(diào)節(jié)機(jī)制,并基于該機(jī)制開發(fā)得到了新的P2X3受體拮抗劑,通過多種動物模型對其止咳藥效和副作用進(jìn)行了評價(jià),證實(shí)該化合物可以在靶向P2X3受體發(fā)揮止咳作用的同時(shí)降低味覺失調(diào)副作用。相關(guān)成果以“Chronic cough relief by allosteric modulation of P2X3 without taste disturbance”為題發(fā)表于《Nature Communications》雜志。這一發(fā)現(xiàn)為靶向P2X3受體治療難治性慢性咳嗽的藥物開發(fā)提供了一種新策略。本文的主要貢獻(xiàn)者為郭常潤副教授,湖南師范大學(xué)聯(lián)合培養(yǎng)碩士研究生張忠哲,中國藥科大學(xué)碩士研究生周杏。全文鏈接如下:https://www.nature.com/articles/s41467-023-41495-0
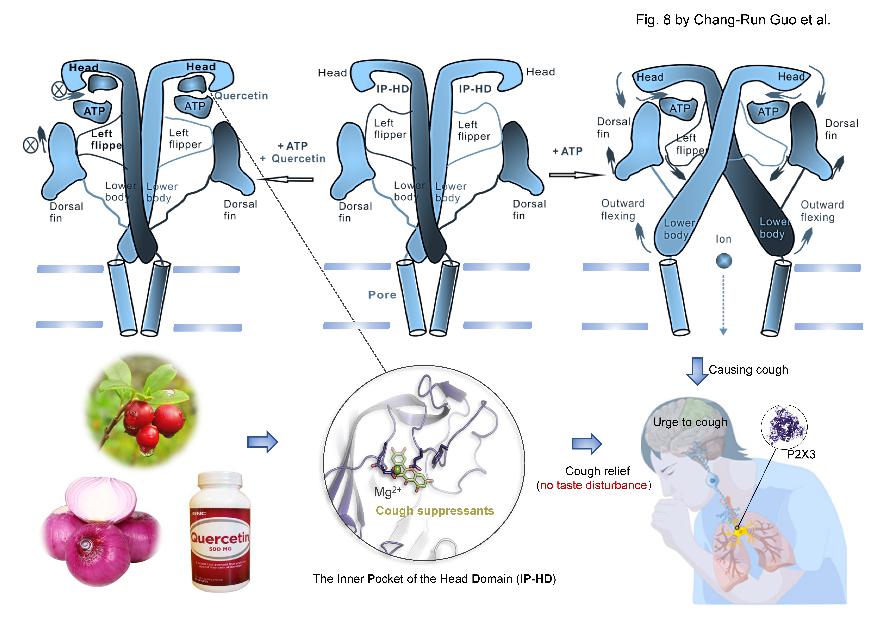
圖3. 靶向P2X3受體治療難治性慢性咳嗽的藥物開發(fā)提供的新策略(圖片來源:Guo CR et al., Nat Commun, 2023.12)
在P2X受體的調(diào)節(jié)機(jī)制方面,該團(tuán)隊(duì)同時(shí)與復(fù)旦大學(xué)服部素之團(tuán)隊(duì)聯(lián)合在《eLife》雜志在線發(fā)表題為“Structural insights into the orthosteric inhibition of P2X receptors by non-ATP-analog antagonists” 的文章,利用單顆粒冷凍電子顯微鏡技術(shù)結(jié)合電生理實(shí)驗(yàn),解析了P2X7受體與兩種磷酸吡哆醛衍生物的復(fù)合物結(jié)構(gòu),并分析了這兩種正構(gòu)拮抗劑對P2X7受體的調(diào)節(jié)作用和機(jī)制,為P2X7亞型特異的藥物設(shè)計(jì)提供結(jié)構(gòu)信息。參與本文的中國藥科大學(xué)的主要貢獻(xiàn)者為郭常潤副教授,中國藥科大學(xué)碩士研究生岳晨茜。全文鏈接如下:https://elifesciences.org/articles/92829
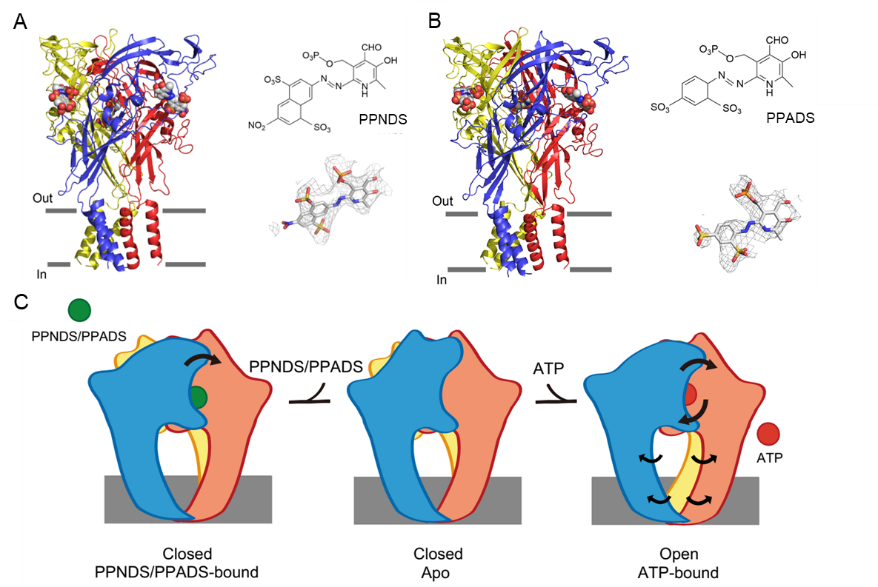
圖4. 靶向P2X3受體治療難治性慢性咳嗽的藥物開發(fā)提供的新策略(圖片來源:Sheng DS et al., eLife, 2024.4)
基礎(chǔ)醫(yī)學(xué)與臨床藥學(xué)學(xué)院于燁教授領(lǐng)銜的膜受體功能與調(diào)控團(tuán)隊(duì),長期從事神經(jīng)、免疫與心血管系統(tǒng)重大疾病相關(guān)膜蛋白跨膜信號轉(zhuǎn)導(dǎo)過程中的關(guān)鍵生物物理問題,疾病的發(fā)病機(jī)制,新藥候選分子發(fā)現(xiàn)及新技術(shù)、新方法的建立等方面的研究。自團(tuán)隊(duì)2018年11月加入中國藥科大學(xué)來,團(tuán)隊(duì)成員已在Neuron(2024),Nat Commun(2023a, 2023b),eLife(2024, 2022),J Clin Invest(2021),Science Bulletin (2023,2018) ,Comput Struct Biotec J (2022, 2024), BJP(2023), APSB (2023) 等期刊發(fā)表一系列研究成果。
(供稿單位:基礎(chǔ)醫(yī)學(xué)與臨床藥學(xué)學(xué)院;撰寫人:高宇,審稿人:沈玲玲、鄭詩翌)





