近日,我校王廣基院士團(tuán)隊(duì)在Cell Host & Microbe上發(fā)表了題為“Microbiota-derived urocanic acid triggered by tyrosine kinase inhibitors potentiates cancer immunotherapy efficacy”研究性論文,并被選為封面論文。我校多靶標(biāo)天然藥物全國重點(diǎn)實(shí)驗(yàn)室博士研究生張夢瑩為第一作者,王廣基院士、周芳研究員、單云龍副研究員為共同通訊作者,甄樂研究員和彭英高級實(shí)驗(yàn)師對本研究有重要貢獻(xiàn),中國藥科大學(xué)為第一通訊單位。

期刊封面
盡管免疫檢查點(diǎn)抑制劑(Immune Checkpoint Inhibitor,ICI)在臨床應(yīng)用中已展現(xiàn)出令人矚目的療效,然而在實(shí)體瘤治療領(lǐng)域,患者對ICI的應(yīng)答率僅為10%-30%。多項(xiàng)臨床研究結(jié)果提示,將ICI療法與酪氨酸激酶抑制劑(Tyrosine kinase inhibitors,TKIs)聯(lián)合應(yīng)用具有顯著的治療潛力,有望為腫瘤患者帶來新的治療希望。但目前關(guān)于這種聯(lián)合療法的潛在作用機(jī)制仍不完全明確。
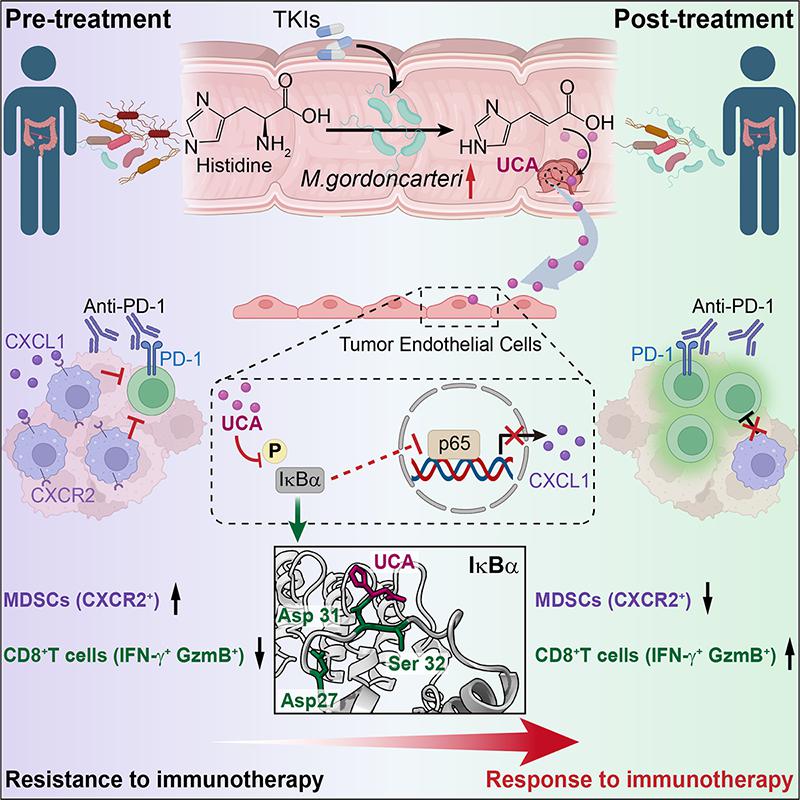
鑒于TKIs為口服藥物,在體內(nèi)必然會與腸道菌群發(fā)生相互作用。團(tuán)隊(duì)基于藥物體內(nèi)過程檢測方法,發(fā)現(xiàn)腸道內(nèi)TKIs通過增加Muribaculum gordoncarteri及其次生代謝物Urocanic acid(UCA)的水平,進(jìn)而增強(qiáng)ICI療效。具體而言,UCA可與IκBα發(fā)生共價(jià)結(jié)合,從而抑制NF-κB通路的活化。這一過程進(jìn)一步導(dǎo)致腫瘤血管內(nèi)皮細(xì)胞中CXCL1表達(dá)減少,最終抑制了由CXCL1-CXCR2軸介導(dǎo)的髓系來源抑制細(xì)胞(Myeloid-derived suppressor cell,MDSC)的招募。綜上所述,該研究闡明了TKIs驅(qū)動腸道菌群代謝,助攻ICI療效的新機(jī)制,也揭示了UCA和M. gordoncarteri可作為ICI響應(yīng)性的生物標(biāo)志物。
示意圖
該研究得到了國自然創(chuàng)新群體項(xiàng)目“代謝調(diào)控與藥物靶標(biāo)發(fā)現(xiàn)”、國家自然科學(xué)基金國際合作項(xiàng)目、國家自然科學(xué)基金面上項(xiàng)目、江蘇省自然科學(xué)基金和深圳市醫(yī)療衛(wèi)生三名工程等項(xiàng)目的支持。
原文鏈接:https://www.cell.com/cell-host-microbe/abstract/S1931-3128(25)00155-6
(供稿單位:多靶標(biāo)天然藥物全國重點(diǎn)實(shí)驗(yàn)室,撰寫人:單思明,審稿人:劉帆)

