近日,藥學院姜虎林教授團隊在權威期刊Advanced Materials(IF: 27.4)和工學學科頂尖期刊Advanced Science(IF: 14.3)相繼發表組織纖維化治療的系列最新研究成果。
組織纖維化是由于器官受損引發過度自愈反應,是組織內細胞外基質異常增多和過度沉積的病理過程。纖維結締組織增生會導致實質細胞減少,持續進展可導致器官結構壞死和功能減退,乃至衰竭,嚴重威脅人類生命健康。
特發性肺纖維化是一種進行性且致命的肺部疾病,其進展受損傷性機械力的影響,最終破壞肺部機械微環境的穩態,導致肺泡功能障礙并進一步加重病情。由于纖維化肺部固有的機械敏感特性,II型肺泡上皮細胞會受到持續拉伸,過度活化的肌成纖維細胞在機械轉導過程中也會形成惡性互作。該研究團隊構建肺部靶向的納米遞送系統,一方面通過促進肺泡的修復和分化,有效降低了II型肺泡上皮細胞的機械張力;另一方面打破肌成纖維細胞收縮性與細胞外基質剛度之間的惡性循環,最終成功恢復肺部力學穩態,有效調控病理狀態下肺部異常的機械力水平。相關工作以“Modulating Fibrotic Mechanical Microenvironment for Idiopathic Pulmonary Fibrosis Therapy”為題發表在Advanced Materials上。延邊大學藥學院博士生李雪娜為第一作者,姜虎林教授為本文唯一通訊作者,中國藥科大學為唯一通訊單位。
全文鏈接:https://doi.org/10.1002/adma.202407661
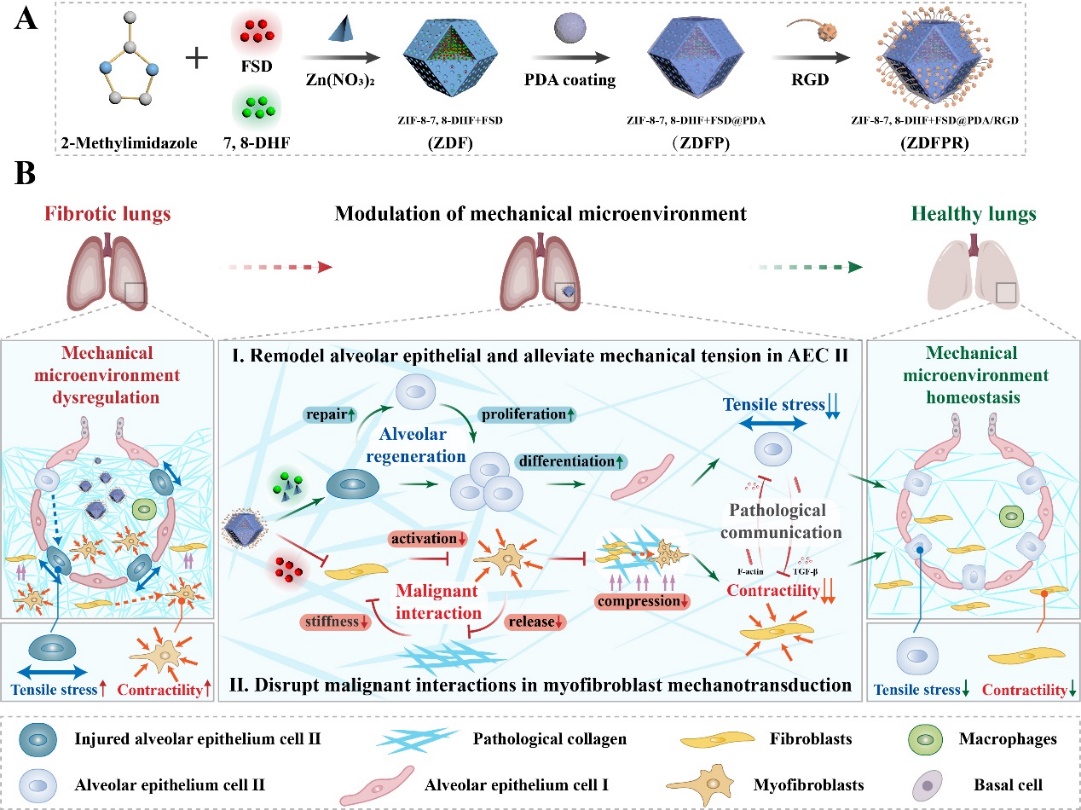
調控肺部機械微環境治療特發性肺纖維化的示意圖
針對纖維化肝臟內“活化的肝星狀細胞-受損的肝實質細胞”相互作用構成惡性循環的病理特點,姜虎林教授團隊構建惡性循環逆轉型藥物遞送系統,抑制TGFβ信號通路和抗氧化應激,從而抑制肝星狀細胞活化并修復受損肝實質細胞,有效調控肝纖維化病理微環境。相關工作以“Pathological Microenvironment-Remodeling Nanoparticles to Alleviate Liver Fibrosis: Reversing Hepatocytes-Hepatic Stellate Cells Malignant Crosstalk’’為題發表在Advanced Science上。藥學院博士生張凌烽、碩士畢業生鄧文琦及王興歡為共同第一作者,姜虎林教授為本文唯一通訊作者,中國藥科大學為唯一通訊單位。
全文鏈接:https://doi.org/10.1002/advs.202408898
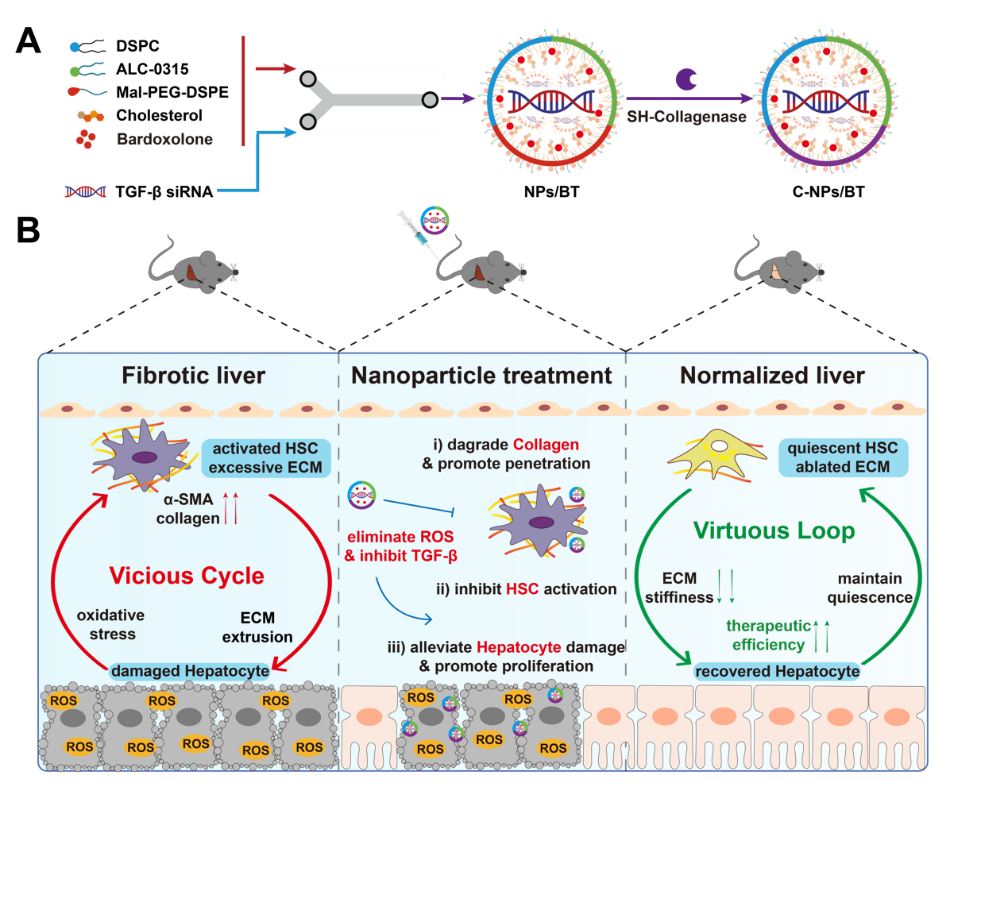
細胞惡性循環逆轉系統治療肝纖維化示意圖
該團隊將進一步聚焦多臟器纖維化的治療,積極推動研究開發向科技成果的落地轉化。以上工作獲得科技部重點研發計劃項目、國家自然科學基金重點國際(地區)合作研究項目以及中國藥科大學天然藥物活性組分與藥效國家重點實驗室研究課題的資助。
(供稿單位:藥學院,撰寫人:劉華,審稿人:劉帆)





